Para descargar o imprimir esta página en un idioma diferente, primero elija su idioma en el menú desplegable en la parte superior izquierda.

Documento de posición de la IAOMT sobre las cavitaciones de la mandíbula humana
Presidente del Comité de Patología de la Mandíbula: Ted Reese, DDS, MAGD, NMD, FIAOMT
Karl Anderson, DDS, MS, NMD, FIAOMT
Patricia Berube, DMD, MS, CFMD, FIAOMT
Jerry Bouquot, DDS, MSD
Teresa Franklin
Jack Kall, DMD, FAGD, MIAOMT
Cody Kriegel, DDS, NMD, FIAOMT
Sushma Lavu, DDS, FIAOMT
Tiffany Shields, DMD, NMD, FIAOMT
Mark Wisniewski, DDS, FIAOMT
El comité desea expresar nuestro agradecimiento a Michael Gossweiler, DDS, MS, NMD, Miguel Stanley, DDS y Stuart Nunally, DDS, MS, FIAOMT, NMD por sus críticas a este artículo. También deseamos reconocer las invaluables contribuciones y el esfuerzo realizado por el Dr. Nunnally al compilar el documento de posición de 2014. Su trabajo, diligencia y práctica constituyeron la columna vertebral de este documento actualizado.
Aprobado por la Junta Directiva de la IAOMT en septiembre de 2023
Tabla de contenido
Tomografía computarizada de haz cónico (CBCT)
Biomarcadores y examen histológico.
Consideraciones en evolución para fines de diagnóstico
Evaluación de meridianos de acupuntura
Implicaciones sistémicas y clínicas
Estrategias de tratamiento alternativas
Referencias
Apéndice I Resultados de la encuesta 2 de la IAOMT
Apéndice II Resultados de la encuesta 1 de la IAOMT
Apéndice III Imágenes
Figura 1 Osteonecrosis grasa degenerativa de la mandíbula (FDOJ)
Figura 2 Citocinas en FDOJ en comparación con controles sanos
Figura 3 Procedimiento quirúrgico para una FDOJ retromolar
Figura 4 Legrado y radiografía correspondiente de FDOJ
Películas Videoclips de cirugía de mandíbula en pacientes.
Durante la última década ha habido una creciente conciencia entre el público y los proveedores de atención médica sobre el vínculo entre la salud bucal y sistémica. Por ejemplo, la enfermedad periodontal es un factor de riesgo tanto para la diabetes como para la enfermedad cardíaca. También se ha demostrado un vínculo potencialmente trascendental y cada vez más investigado entre la patología de la mandíbula y la salud y vitalidad general del individuo. El uso de modalidades de imágenes técnicamente avanzadas, como la tomografía computarizada de haz cónico (CBCT), ha sido fundamental para identificar patologías de la mandíbula, lo que ha llevado a mejores capacidades de diagnóstico y una mejor capacidad para evaluar el éxito de las intervenciones quirúrgicas. Los informes científicos, los docudramas y las redes sociales han aumentado la conciencia pública sobre estas patologías, especialmente entre aquellas personas que padecen afecciones neurológicas o sistémicas crónicas inexplicables que no responden a las intervenciones médicas o dentales tradicionales.
La Academia Internacional de Medicina Oral y Toxicología (IAOMT) se basa en la creencia de que la ciencia debe ser la base sobre la cual se elijan y utilicen todas las modalidades de diagnóstico y tratamiento. Con esta prioridad en mente, 1) proporcionamos esta actualización de nuestro documento de posición sobre osteonecrosis de la mandíbula de la IAOMT de 2014 y 2) proponemos, basándose en la observación histológica, un nombre más científico y médico más preciso para la enfermedad, específicamente, enfermedad medular isquémica crónica. de la Mandíbula (CIMDJ). CIMDJ describe una afección ósea caracterizada por la muerte de los componentes celulares del hueso esponjoso, secundaria a una interrupción del suministro de sangre. A lo largo de su historia, lo que llamamos CIMDJ ha recibido multitud de nombres y siglas que se enumeran en la Tabla 1 y que se analizarán brevemente a continuación.
El objetivo y la intención de esta Academia y el artículo es proporcionar ciencia, investigación y observaciones clínicas para que los pacientes y los médicos tomen decisiones informadas al considerar estas lesiones CIMDJ, que a menudo se denominan cavitaciones de la mandíbula. Este artículo de 2023 fue elaborado en un esfuerzo conjunto que incluyó a médicos, investigadores y un eminente patólogo de la mandíbula, el Dr. Jerry Bouquot, tras la revisión de más de 270 artículos.
En ningún otro hueso el potencial de sufrir traumatismos e infecciones es tan grande como en los maxilares. Una revisión de la literatura relacionada con el tema de las cavitaciones de la mandíbula (es decir, CIMDJ) muestra que esta condición ha sido diagnosticada, tratada e investigada desde la década de 1860. En 1867, el Dr. HR Noel realizó una presentación titulada Una conferencia sobre caries y necrosis ósea. en el Baltimore College of Dental Surgery, y en 1901 William C. Barrett analiza detalladamente las cavitaciones de la mandíbula en su libro de texto titulado Oral Pathology and Practice: A Textbook for the Use of Students in Dental Colleges and a Handbook for Dental Practitioners. GV Black, a menudo denominado el padre de la odontología moderna, incluyó una sección en su libro de texto de 1915, Patología dental especial, para describir "la apariencia y el tratamiento habituales" de lo que describió como osteonecrosis de la mandíbula (JON).
La investigación sobre las cavitaciones de la mandíbula pareció detenerse hasta la década de 1970, cuando otros comenzaron a investigar el tema, utilizando una variedad de nombres y etiquetas, y publicando información al respecto en los libros de texto de patología bucal modernos. Por ejemplo, en 1992 Bouquot et al observaron inflamación intraósea en pacientes con dolor facial crónico y severo (N=135) y acuñaron el término "Osteonecrosis cavitacional inductora de neuralgia" o NICO. Aunque Bouquot et al no comentaron sobre la etiología de la enfermedad, concluyeron que era probable que las lesiones indujeran una neuralgia facial crónica con características locales únicas: formación de cavidad intraósea y necrosis ósea de larga duración con curación mínima. En un estudio clínico de pacientes con neuralgia del trigémino (N=38) y facial (N=33), Ratner et al también demostraron que casi todos los pacientes tenían caries en el hueso alveolar y la mandíbula. Las caries, a veces de más de 1 centímetro de diámetro, se encontraban en lugares de extracciones dentales anteriores y generalmente no eran detectables mediante rayos X.

 En la literatura existe una variedad de otros términos para lo que identificamos como CIMDJ. Estos se enumeran en la Tabla 1 y se analizan brevemente aquí. Adams et al acuñaron el término osteomielitis fibrosante crónica (CFO) en un documento de posición de 2014. El documento de posición fue el resultado de un consorcio multidisciplinario de profesionales de los campos de Medicina Oral, Endodoncia, Patología Oral, Neurología, Reumatología, Otorrinolaringología, Periodoncia, Psiquiatría, Radiología Oral y Maxilofacial, Anestesia, Odontología General, Medicina Interna y Manejo del Dolor. . El objetivo del grupo era proporcionar una plataforma interdisciplinaria para tratar enfermedades asociadas con la cabeza, el cuello y la cara. Gracias a los esfuerzos colectivos de este grupo, búsquedas exhaustivas de literatura y entrevistas a pacientes, surgió un patrón clínico distinto, al que denominaron CFO. Observaron que esta enfermedad a menudo no se diagnostica debido a sus comorbilidades con otras afecciones sistémicas. Este grupo señaló los vínculos potenciales entre la enfermedad y los problemas de salud sistémicos y la necesidad de un equipo de médicos para diagnosticar y tratar adecuadamente al paciente.
En la literatura existe una variedad de otros términos para lo que identificamos como CIMDJ. Estos se enumeran en la Tabla 1 y se analizan brevemente aquí. Adams et al acuñaron el término osteomielitis fibrosante crónica (CFO) en un documento de posición de 2014. El documento de posición fue el resultado de un consorcio multidisciplinario de profesionales de los campos de Medicina Oral, Endodoncia, Patología Oral, Neurología, Reumatología, Otorrinolaringología, Periodoncia, Psiquiatría, Radiología Oral y Maxilofacial, Anestesia, Odontología General, Medicina Interna y Manejo del Dolor. . El objetivo del grupo era proporcionar una plataforma interdisciplinaria para tratar enfermedades asociadas con la cabeza, el cuello y la cara. Gracias a los esfuerzos colectivos de este grupo, búsquedas exhaustivas de literatura y entrevistas a pacientes, surgió un patrón clínico distinto, al que denominaron CFO. Observaron que esta enfermedad a menudo no se diagnostica debido a sus comorbilidades con otras afecciones sistémicas. Este grupo señaló los vínculos potenciales entre la enfermedad y los problemas de salud sistémicos y la necesidad de un equipo de médicos para diagnosticar y tratar adecuadamente al paciente.
También se han observado lesiones cavitacionales en la mandíbula en niños. En 2013, Obel et al describieron lesiones en niños y acuñaron el término osteomielitis crónica mandibular juvenil (JMCO). Este grupo sugirió el posible uso de bifosfonatos intravenosos (IV) como tratamiento para estos niños. En 2016, Padwa et al publicaron un estudio que describe una osteítis inflamatoria focal estéril en la mandíbula de pacientes pediátricos. Etiquetaron la lesión como osteomielitis crónica no bacteriana pediátrica (CNO).
Desde 2010, el Dr. Johann Lechner, el autor e investigador con más publicaciones sobre lesiones cavitacionales de la mandíbula, y otros han estado investigando la relación de estas lesiones con la producción de citocinas, especialmente la citocina inflamatoria RANTES (también conocida como CCL5). El Dr. Lechner ha utilizado varios términos para describir estas lesiones que incluyen la NICO mencionada anteriormente, pero también la osteonecrosis isquémica aséptica en la mandíbula (AIOJ) y la osteonecrosis grasa degenerativa de la mandíbula (FDOJ). Su descripción/etiqueta se basa en la apariencia física y/o la condición macroscópicamente patológica que se observa clínica o intraoperatoriamente.
Ahora existe la necesidad de aclarar otra patología de la mandíbula identificada más recientemente que es distinta del tema de este artículo pero que podría resultar confusa para quienes investigan las lesiones cavitacionales. Son lesiones óseas de la mandíbula que surgen como consecuencia del uso de productos farmacéuticos. Las lesiones se caracterizan mejor por la pérdida del suministro de sangre con el posterior secuestro incontrolable de hueso. Estas lesiones han sido denominadas Ulceración Oral con Secuestro Óseo (OUBS) por Ruggiero et al en un documento de posición para Asociación Americana de Cirujanos Orales y Maxilofaciales (AAOMS), así como por Palla et al, en una revisión sistemática. Dado que este problema está relacionado con el uso de uno o varios productos farmacéuticos, la IAOMT considera que este tipo de lesión se describe mejor como osteonecrosis de la mandíbula relacionada con medicamentos (MRONJ). MRONJ no se discutirá en este artículo ya que su etiología y enfoques de tratamiento son diferentes a los de lo que llamamos CIMDJ, y ya se ha estudiado ampliamente anteriormente.
El uso cada vez más común de radiografías de tomografía computarizada de haz cónico (CBCT) por parte de muchos odontólogos ha llevado a un aumento en la observación de las cavitaciones intramedulares a las que nos referimos como CIMDJ, y que anteriormente se pasaban por alto y, por lo tanto, se ignoraban. Ahora que estas lesiones y anomalías se identifican más fácilmente, es responsabilidad de la profesión dental diagnosticar la enfermedad y brindar recomendaciones de tratamiento y atención.
Apreciar e identificar la existencia del CIMDJ es el punto de partida para comprenderlo. Independientemente de los muchos nombres y siglas que se han asociado con la patología, la presencia de hueso necrótico o moribundo en el componente medular de la mandíbula está bien establecida.
Cuando se observan durante la cirugía, estos defectos óseos se presentan de numerosas maneras. Algunos médicos informan que más del 75% de las lesiones son completamente huecas o están llenas de tejido suave, de color marrón grisáceo y desmineralizado/granuloma, a menudo con material aceitoso amarillo (quistes oleosos) que se encuentra en las áreas defectuosas con anatomía ósea normal circundante. Otros informan la presencia de cavitaciones que tienen una densidad variable de hueso cortical superpuesto que, al abrirse, parecen tener revestimientos con materiales filamentosos fibrosos de color negro, marrón o gris. Otros más informan cambios importantes descritos de diversas formas como “arenosos”, “como aserrín”, “caries huecas” y “secos” con ocasionalmente dureza esclerótica, similar a la de un diente, en las paredes de la cavidad. Tras el examen histológico, estas lesiones parecen similares a la necrosis que ocurre en otros huesos del cuerpo y son histológicamente diferentes de la osteomielitis (consulte la Figura 1). En el Apéndice III al final de este documento se incluyen imágenes adicionales que ilustran la enfermedad de CIMDJ, algunas de ellas de naturaleza gráfica.
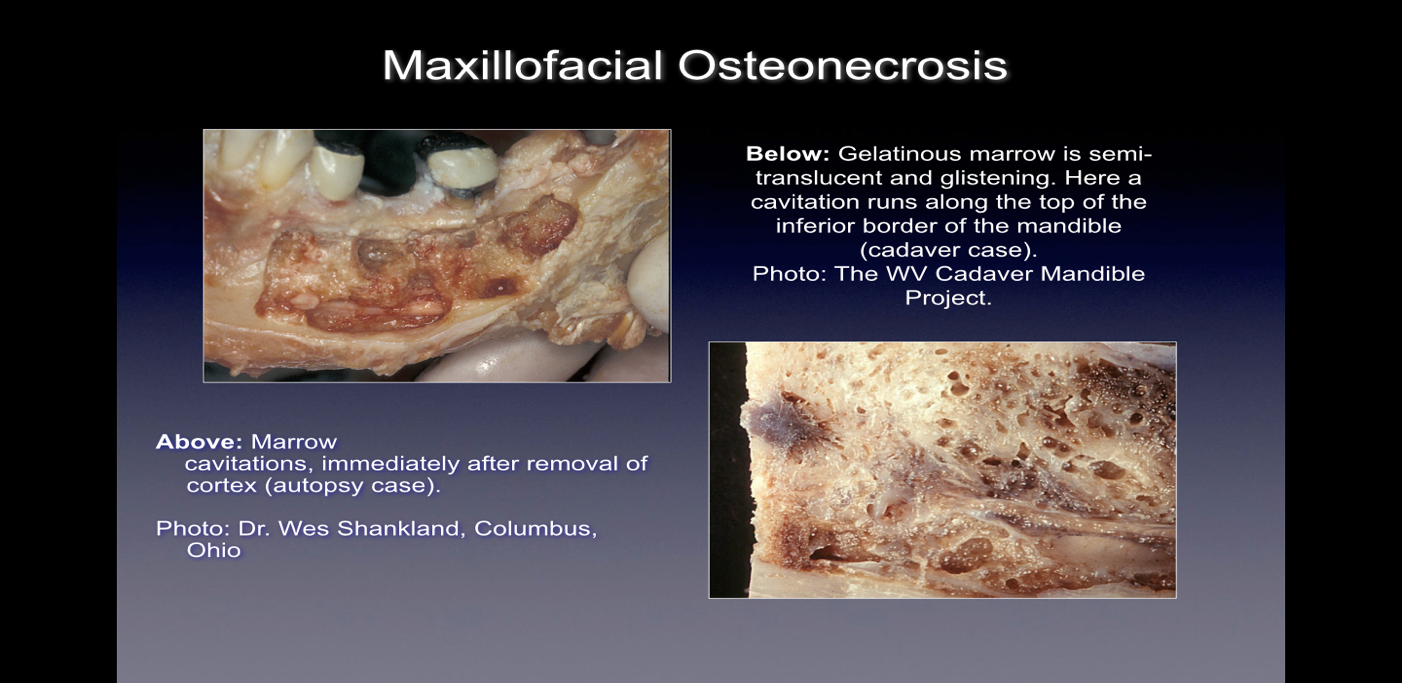
Figura 1 y XNUMX Imágenes del CIMDJ extraídas de un cadáver
Al igual que otros profesionales de la salud, los dentistas utilizan un proceso organizado que utiliza varios métodos y modalidades para diagnosticar las lesiones cavitacionales. Estos pueden consistir en realizar un examen físico que incluye tomar un historial médico, evaluar síntomas, obtener fluidos corporales para realizar pruebas de laboratorio y obtener muestras de tejido para biopsia y pruebas microbiológicas (es decir, pruebas para detectar la presencia de patógenos). También se utilizan a menudo tecnologías de imágenes, como la CBCT. En pacientes con trastornos complejos que no siempre siguen un patrón o no se ajustan a un orden típico de un complejo sintomático, el proceso de diagnóstico puede requerir un análisis más detallado que al principio sólo podría dar como resultado un diagnóstico diferencial. A continuación se proporcionan breves descripciones de varias de estas modalidades de diagnóstico.
Tomografía computarizada de haz cónico (CBCT)
Las técnicas de diagnóstico descritas ya en 1979 por Ratner y sus colegas, que utilizan palpación y presiones digitales, inyecciones diagnósticas de anestésicos locales, consideración de los antecedentes médicos y la ubicación del dolor irradiado, son útiles para diagnosticar las cavitaciones de la mandíbula. Sin embargo, si bien algunas de estas lesiones causan dolor, hinchazón, enrojecimiento e incluso fiebre, otras no. Por lo tanto, a menudo es necesaria una medida más objetiva, como las imágenes.
Las cavitaciones generalmente no se detectan en películas radiográficas bidimensionales estándar (2-D, como periapical y panorámica) que se usan comúnmente en odontología. Ratner y sus colegas han demostrado que es necesario alterar el 40% o más del hueso para mostrar cambios, y esto está respaldado por trabajos posteriores, como se ilustra en la Figura 2. Esto está relacionado con la limitación inherente de las imágenes 2D que causa la superposición. de estructuras anatómicas, enmascarando áreas de interés. En el caso de defectos o patologías, específicamente en la mandíbula, el efecto de enmascaramiento del hueso cortical denso sobre las estructuras subyacentes puede ser significativo. Por lo tanto, se requieren técnicas de imágenes tecnológicamente avanzadas, como CBCT, exploraciones Tech 99, imágenes por resonancia magnética (MRI) o ecografía transalveolar (CaviTAU™®).
De las diversas técnicas de imagen disponibles, la CBCT es la herramienta de diagnóstico más utilizada por los odontólogos implicados en el diagnóstico o tratamiento de las cavitaciones y, por tanto, de la que hablaremos en profundidad. La piedra angular de la tecnología CBCT es su capacidad para visualizar una lesión de interés en 3 dimensiones (frontal, sagital, coronal). CBCT ha demostrado ser un método confiable y preciso para identificar y estimar el tamaño y la extensión de los defectos intraóseos en la mandíbula con menos distorsión y menos aumento que las radiografías 2D.
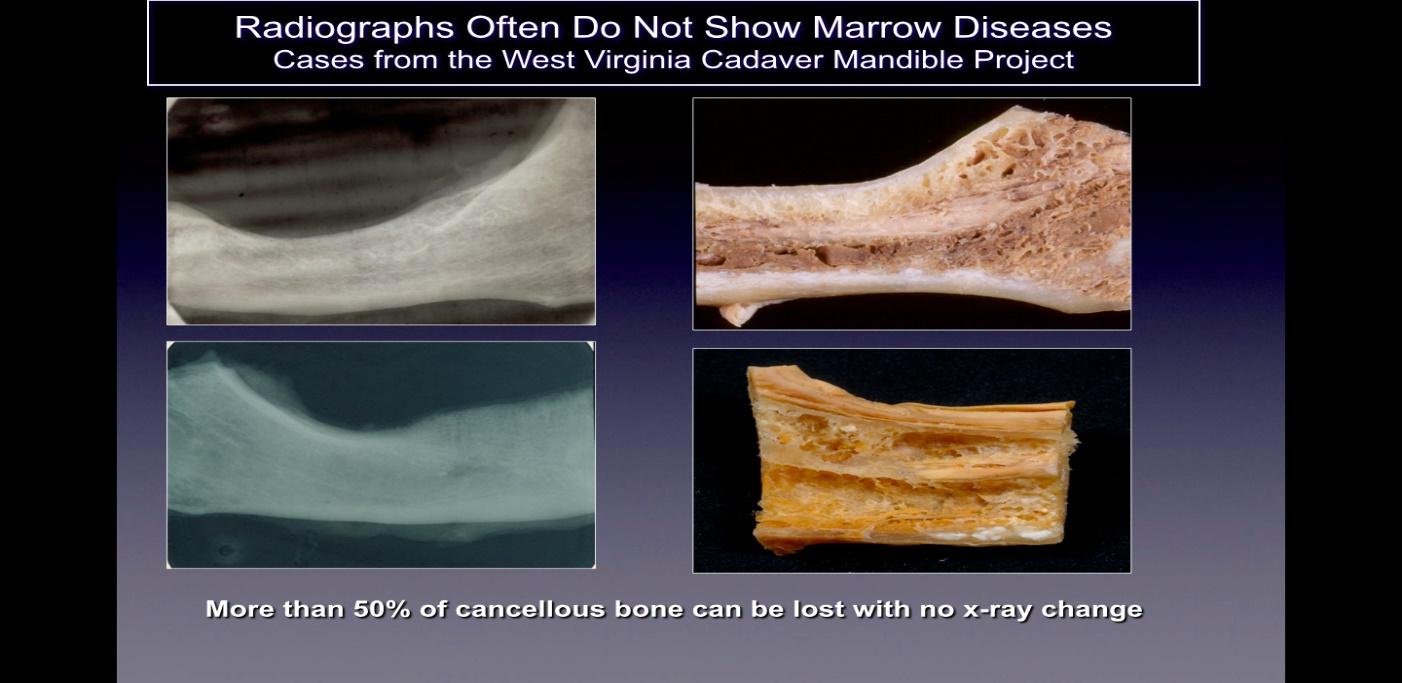
Figura 2 y XNUMX Leyenda: En el lado izquierdo se muestran radiografías bidimensionales de mandíbulas tomadas de cadáveres que parecen
saludable. En el lado derecho de la figura hay fotografías de las mismas mandíbulas que muestran una cavitación necrótica obvia.
Figura adaptada de Bouquot, 2014.
Los estudios clínicos han demostrado que las imágenes CBCT también ayudan a determinar el contenido de una lesión (llena de líquido, granulomatosa, sólida, etc.), lo que posiblemente ayude a distinguir entre lesiones inflamatorias, tumores odontógenos o no odontógenos, quistes y otros tumores benignos o malignos. lesiones .
El software desarrollado recientemente que se integra específicamente con diferentes tipos de dispositivos CBCT utiliza unidades Hounsfield (HU) que permiten una evaluación estandarizada de la densidad ósea. Las HU representan la densidad relativa de los tejidos corporales según una escala calibrada de nivel de grises, basada en valores de aire (-1000 HU), agua (0 HU) y densidad ósea (+1000 HU). La Figura 3 muestra diferentes vistas de una imagen CBCT moderna.
En resumen, la CBCT ha demostrado ser útil en el diagnóstico y tratamiento de las cavitaciones de la mandíbula al:
- Identificar el tamaño, extensión y posición tridimensional de una lesión;
- Identificar la proximidad de una lesión a otras estructuras anatómicas vitales cercanas, como la
nervio alveolar inferior, seno maxilar o raíces de dientes adyacentes;
- Determinación del enfoque de tratamiento: quirúrgico versus no quirúrgico; y
- Proporcionar una imagen de seguimiento para determinar el grado de curación y la posible necesidad.
volver a tratar una lesión.
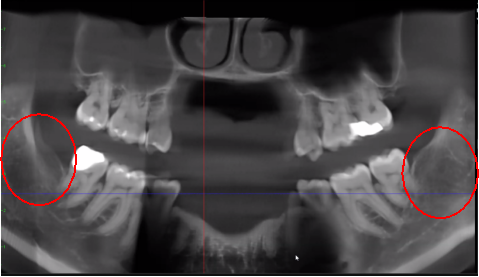
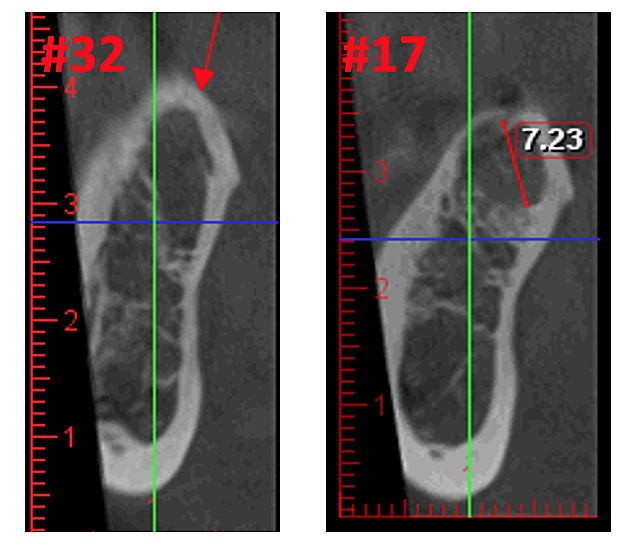
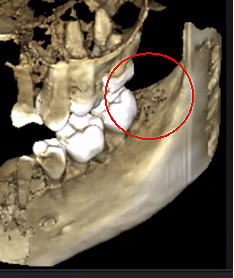
Figura 3 y XNUMX Claridad mejorada de la imagen CBCT debido a la tecnología de software refinada, que reduce los artefactos y el "ruido" que los implantes dentales y las restauraciones metálicas pueden causar en la imagen. Esto permite al dentista y al paciente visualizar la lesión más fácilmente. El panel superior es una vista panorámica de una CBCT que muestra la ubicación izquierda (#17) y derecha (#32) y la extensión de las lesiones cavitacionales en un paciente con osteonecrosis de la mandíbula. El panel inferior izquierdo es una vista sagital de cada sitio. El panel inferior derecho es una representación tridimensional del sitio n.º 3 que muestra la porosidad cortical superpuesta a la cavitación medular. Cortesía del Dr. Reese.
También mencionamos brevemente aquí un dispositivo de ultrasonido, el CaviTAU™®, que se ha desarrollado y se utiliza en algunas partes de Europa, específicamente para detectar áreas de baja densidad ósea de los maxilares superior e inferior que sugieren cavitaciones maxilares. Este dispositivo de ecografía ultrasónica transalveolar (TAU-n) es potencialmente igual en comparación con la CBCT para detectar defectos de la médula ósea y tiene el beneficio adicional de exponer al paciente a niveles mucho más bajos de radiación. Este dispositivo no está disponible actualmente en los EE. UU., pero está siendo revisado por la Administración de Alimentos y Medicamentos de los EE. UU. y bien podría ser la principal herramienta de diagnóstico utilizada en América del Norte para tratar la CIMJD.
Biomarcadores y examen histológico.
Debido a la naturaleza inflamatoria de las cavitaciones de la mandíbula, Lechner y Baehr, en 2017, investigaron la posible relación entre citocinas seleccionadas y la enfermedad. Una citocina de particular interés está "regulada tras la activación, expresada y secretada por las células T normales" (RANTES). Esta citocina, así como el factor de crecimiento de fibroblastos (FGF)-2, se expresa en mayores cantidades en lesiones cavitacionales y en pacientes con CIMDJ. La Figura 4, proporcionada por el Dr. Lechner, compara los niveles de RANTES en pacientes con cavitaciones (barra roja, izquierda) con los niveles en controles sanos (barra azul), mostrando niveles que son más de 25 veces mayores en aquellos con la enfermedad. Lechner et al utilizan dos enfoques para medir los niveles de citoquinas. Una es medir los niveles de citocinas sistémicamente en la sangre (Laboratorio de soluciones de diagnóstico, EE. UU..). Un segundo método consiste en tomar una biopsia directamente del sitio enfermo cuando se accede a él para ser evaluado por un patólogo bucal. Desafortunadamente, en este momento el muestreo de tejido localizado requiere un procesamiento y envío complejos que aún no se han logrado en instalaciones ajenas a la investigación, pero han proporcionado correlaciones reveladoras.
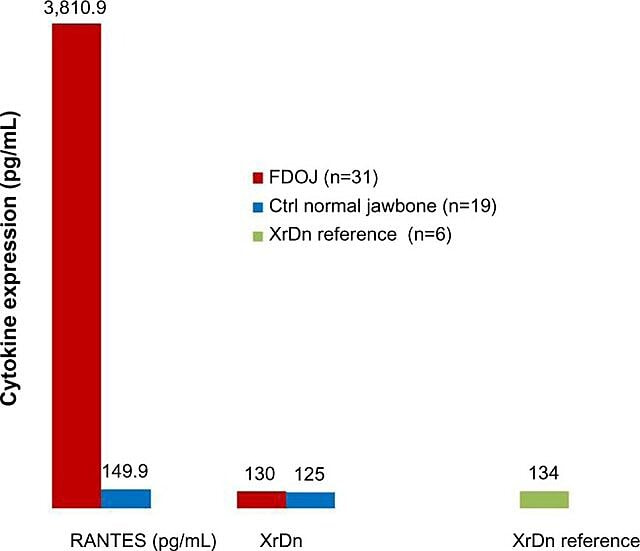
Figura 4 y XNUMX Distribución de RANTES en 31 casos FDOJ y 19 muestras de mandíbula normal en comparación con una referencia de densidad de rayos X para ambos grupos en las áreas correspondientes. abreviaturas: RANTES, regulado tras la activación, ligando 5 de quimiocina (motivo CC) expresado y secretado por células T normales; XrDn, densidad de rayos X; FDOJ: osteonecrosis grasa degenerativa de la mandíbula; n, número; Controlar, controlar. Figura proporcionada por el Dr. Lechner. Número de licencia: CC BY-NC 3.0
Consideraciones en evolución para fines de diagnóstico
La presencia de cavitaciones mandibulares ha sido bien establecida clínicamente. Sin embargo, es necesario realizar más investigaciones para lograr diagnósticos claros y parámetros de tratamiento de mejores prácticas. Teniendo esto en cuenta, es necesario mencionar brevemente algunas técnicas intrigantes y potencialmente valiosas que están utilizando algunos profesionales.
Se reconoce que evaluaciones fisiológicas adicionales serían una valiosa herramienta de detección y diagnóstico. Una de esas herramientas que utilizan algunos profesionales es la obtención de imágenes termográficas. La actividad inflamatoria generalizada se puede observar midiendo las diferencias de calor en la superficie de la cabeza y el cuello. La termografía es segura, rápida y puede tener un valor diagnóstico similar al de la CBCT. Un inconveniente importante es que carece de definición, lo que dificulta discernir el margen o la extensión de una lesión.
Evaluación de meridianos de acupuntura
Algunos profesionales analizan el perfil energético de una lesión utilizando la Evaluación de Meridianos de Acupuntura (AMA) para determinar su efecto en su meridiano de energía correspondiente. Este tipo de valoración se basa en la Electroacupuntura Según Voll (EAV). Esta técnica, que se basa en los antiguos principios de la acupuntura y la medicina china, ha sido desarrollada y se enseña en los EE. UU. La acupuntura se ha utilizado para aliviar el dolor y promover la curación. Se basa en el equilibrio del flujo de energía (es decir, Chi) a través de vías de energía específicas en el cuerpo. Estas vías, o meridianos, conectan órganos, tejidos, músculos y huesos específicos entre sí. La acupuntura utiliza puntos muy específicos de un meridiano para influir en la salud y la vitalidad de todos los elementos del cuerpo en ese meridiano. Esta técnica se ha utilizado para revelar enfermedades de la mandíbula, que cuando se resuelve, también trata enfermedades aparentemente no relacionadas, como la artritis o el síndrome de fatiga crónica. Esta técnica se presta a una mayor investigación (es decir, es necesario documentar los resultados y adquirir y difundir datos longitudinales).
Hay muchos factores individuales que aumentan el riesgo de desarrollar cavitaciones en la mandíbula, pero normalmente el riesgo es multifactorial. Los riesgos para el individuo pueden ser influencias externas, como factores ambientales, o influencias internas, como una función inmune deficiente. Las tablas 2 y 3 enumeran los factores de riesgo externos e internos.


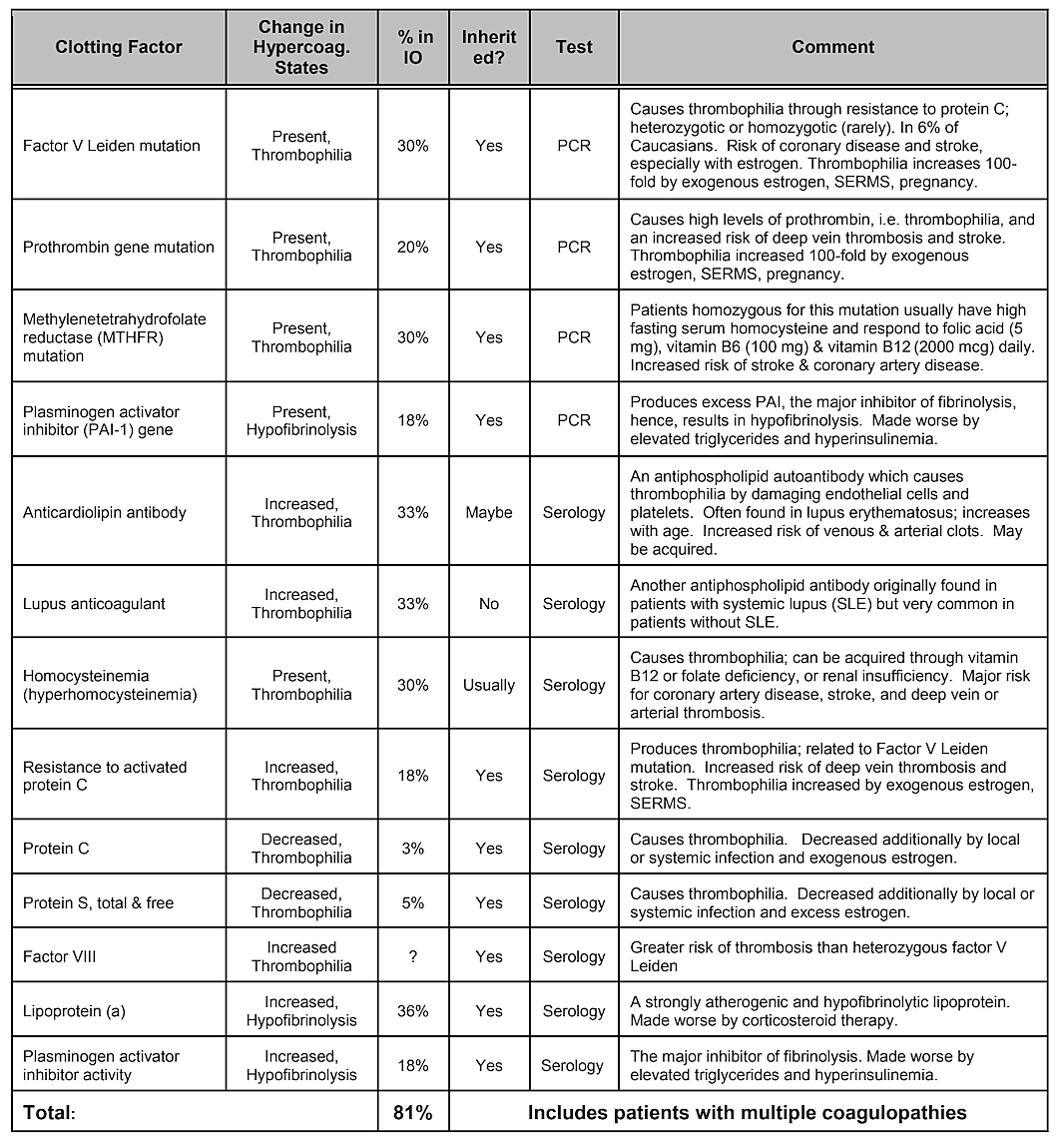
Tenga en cuenta que la Tabla 2, Factores de riesgo internos, no incluye la predisposición genética. Si bien se cree que las variaciones genéticas desempeñan un papel, No se ha demostrado que una sola variación genética o incluso una combinación de genes sean identificadas como un factor de riesgo; sin embargo, es probable que existan influencias genéticas. . Una revisión sistemática de la literatura realizada en 2019 mostró que se han identificado varios polimorfismos de un solo nucleótido, pero no hay replicación entre los estudios. Los autores concluyeron que, dada la diversidad de genes que han mostrado asociaciones positivas con las cavitaciones y la falta de reproducibilidad de los estudios, el papel desempeñado por las causas genéticas parecería moderado y heterogéneo. Sin embargo, puede ser necesario dirigirse a poblaciones específicas para identificar diferencias genéticas. De hecho, como se ha demostrado, uno de los mecanismos fisiopatológicos más comunes y básicos del daño óseo isquémico es el exceso de coagulación debido a estados de hipercoagulación, que generalmente tienen bases genéticas, como lo describen Bouquot y Lamarche (1999). La Tabla 4 proporcionada por el Dr. Bouquot enumera los estados patológicos que involucran hipercoagulación y los siguientes 3 párrafos brindan una descripción general de algunos de los hallazgos del Dr. Bouquot que presentó en su función como Director de Investigación en el Centro Maxilofacial para Educación e Investigación.
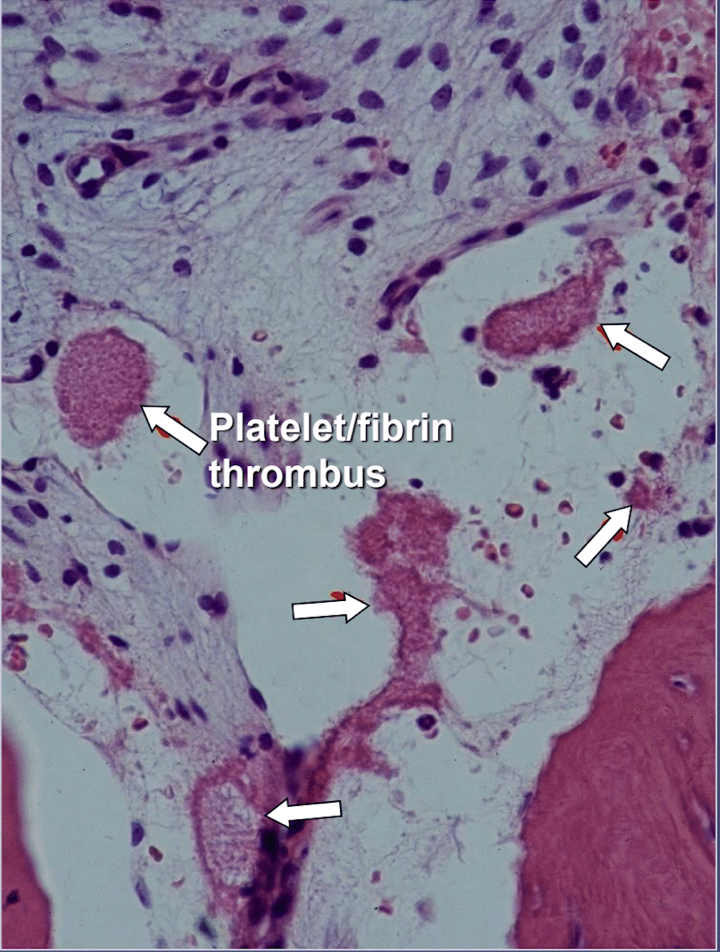
En las cavitaciones de la mandíbula hay evidencia clara de osteonecrosis isquémica, que es una enfermedad de la médula ósea en la que el hueso se vuelve necrótico debido a la falta de oxígeno y nutrientes. Como se mencionó, muchos factores pueden interactuar para producir cavitaciones y hasta el 80% de los pacientes tienen un problema, generalmente hereditario, de producción excesiva de coágulos sanguíneos en sus vasos sanguíneos. Esta enfermedad normalmente no se revela durante los análisis de sangre de rutina. El hueso es particularmente susceptible a este problema de hipercoagulación y desarrolla vasos sanguíneos muy dilatados; presiones internas aumentadas, a menudo dolorosas; estancamiento de sangre; e incluso infartos. Este problema de hipercoagulación podría ser sugerido por antecedentes familiares de accidente cerebrovascular y ataques cardíacos a una edad temprana (menos de 55 años), reemplazo de cadera o "artritis" (especialmente a una edad temprana), osteonecrosis (especialmente a una edad temprana), profunda trombosis venosa, embolias pulmonares (coágulos de sangre en los pulmones), trombosis venosa retiniana (coágulos en la retina del ojo) y abortos espontáneos recurrentes. Las mandíbulas tienen 2 problemas específicos con esta enfermedad: 1) una vez dañado, el hueso enfermo no puede resistir infecciones de bajo grado causadas por bacterias de dientes y encías; y 2) es posible que el hueso no se recupere de la disminución del flujo sanguíneo inducida por los anestésicos locales utilizados por los dentistas durante el trabajo dental. La Figura 5 proporciona una vista microscópica de un trombo intravascular.
Tabla 4 Estados patológicos que implican hipercoagulación. Cuatro de cada cinco pacientes con cavitación mandibular tienen uno de estos problemas de coagulación.
problemas de factores
Independientemente de la causa subyacente de la hipercoagulación, el hueso desarrolla una médula fibrosa (las fibras pueden vivir en áreas carentes de nutrientes), una médula grasa muerta y grasosa (“podredumbre húmeda”), una médula muy seca, a veces coriácea (“podredumbre seca”). ), o un espacio medular completamente hueco (“cavitación”).
Cualquier hueso puede verse afectado, pero los más afectados son las caderas, las rodillas y la mandíbula. El dolor suele ser intenso, pero aproximadamente 1/3rd de los pacientes no experimentan dolor. El cuerpo tiene problemas para curarse de esta enfermedad y 2/3rds de los casos requieren la extirpación quirúrgica de la médula dañada, generalmente mediante raspado con curetas. La cirugía eliminará el problema (y el dolor) en casi 3/4THS de los pacientes con afectación de la mandíbula, aunque en el 40% de los pacientes se requieren cirugías repetidas, generalmente procedimientos más pequeños que los primeros, a veces en otras partes de la mandíbula, porque la enfermedad frecuentemente presenta lesiones "saltadas" (es decir, múltiples sitios en la mandíbula). huesos iguales o similares), con médula normal entre ellos. Más de la mitad de los pacientes de cadera acabarán padeciendo la enfermedad en la cadera opuesta. Más de 1/3rd de los pacientes con mandíbula contraerán la enfermedad en otros cuadrantes de la mandíbula. Recientemente, se ha descubierto que el 40% de los pacientes con osteonecrosis de cadera o mandíbula responderán a la anticoagulación con heparina de bajo peso molecular (Lovenox) o Coumadin con resolución del dolor y curación ósea.
Figura 5 y XNUMX Vista microscópica de trombos intravasculares.
Si se busca un enfoque no farmacéutico para reducir el riesgo de hipercoagulación, se puede considerar el uso de enzimas suplementarias como la nattoquinasa o la más potente lumbroquinasa, las cuales tienen propiedades fibrinolíticas y anticoagulantes. Además, deben descartarse los estados de deficiencia de cobre, que están asociados con disfunción de la coagulación, debido al mayor riesgo de hipercoagulación observado en pacientes con cavitaciones de la mandíbula.
IMPLICACIONES SISTÉMICAS Y CLÍNICAS
La presencia de cavitaciones mandibulares y su patología asociada abarcan algunos síntomas específicos pero a menudo también incluyen algunos síntomas sistémicos no específicos. Por lo tanto, su diagnóstico y tratamiento deben abordarse con minuciosa consideración por parte del equipo de atención. El descubrimiento más singular e innovador que ha salido a la luz desde el documento de posición de la IAOMT de 2014 es la resolución de afecciones inflamatorias crónicas aparentemente no relacionadas después del tratamiento con cavitación. Ya sea que las enfermedades sistémicas sean de naturaleza autoinmune o que la inflamación se produzca de otro modo, se han informado mejoras significativas, incluida una mejora en el cáncer. El complejo de síntomas asociado con estas lesiones es altamente individualizado y, por lo tanto, no es generalizable ni fácilmente reconocible. Por lo tanto, la IAOMT tiene la mentalidad de que cuando a un paciente se le diagnostica cavitaciones de la mandíbula con o sin dolor localizado asociado, y también tiene otra enfermedad sistémica previamente no atribuida a las cavitaciones de la mandíbula, el paciente necesita una evaluación adicional para determinar si la enfermedad está asociada con , o es consecuencia de la enfermedad. La IAOMT encuestó a sus miembros para obtener más información sobre qué síntomas/enfermedades sistémicos se resuelven después de la cirugía cavitacional. Los resultados se presentan en el Apéndice I.
La presencia de citoquinas generadas en lesiones necróticas pobremente vascularizadas de cavitaciones mandibulares parece funcionar como un foco de citocinas inflamatorias que mantienen otras áreas de inflamación activas y/o crónicas. Se espera y se espera el alivio o al menos la mejora del dolor de mandíbula localizado después del tratamiento, pero esta teoría focal de la inflamación, que se discutirá en detalle a continuación, puede explicar por qué tantas enfermedades aparentemente "no relacionadas" que tienen vínculos con afecciones inflamatorias crónicas. También se reducen con el tratamiento de cavitación.
En apoyo de las conclusiones extraídas en el documento de posición de la IAOMT de 2014 que vincula las cavitaciones de la mandíbula y las enfermedades sistémicas, las investigaciones y los estudios clínicos publicados más recientemente por Lechner, von Baehr y otros muestran que las lesiones de cavitación de la mandíbula contienen un perfil de citocinas específico que no se observa en otras patologías óseas. . En comparación con muestras de mandíbula sana, las patologías de cavitación muestran continuamente una fuerte regulación positiva del factor de crecimiento de fibroblastos (FGF-2), del antagonista del receptor de interleucina 1 (Il-1ra) y, de particular importancia, de RANTES. RANTES, también conocida como CCL5 (ligando 5 con motivo cc), se ha descrito como una citocina quimiotáctica con una fuerte acción proinflamatoria. Se ha demostrado que estas quimiocinas interfieren en varias etapas de la respuesta inmune y están sustancialmente involucradas en diversas condiciones patológicas e infecciones. Los estudios han demostrado que RANTES está implicado en muchas enfermedades sistémicas como la artritis, el síndrome de fatiga crónica, la dermatitis atópica, la nefritis, la colitis, la alopecia, los trastornos de la tiroides y la promoción de la esclerosis múltiple y la enfermedad de Parkinson. Además, se ha demostrado que RANTES provoca una aceleración del crecimiento tumoral.
Los factores de crecimiento de fibroblastos también han sido implicados en las cavitaciones de la mandíbula. Los factores de crecimiento de fibroblastos, FGF-2, y sus receptores asociados, son responsables de muchas funciones cruciales, incluida la proliferación, supervivencia y migración celular. También son susceptibles de ser secuestrados por células cancerosas y desempeñar un papel oncogénico en muchos cánceres. Por ejemplo, FGF-2 promueve la progresión tumoral y del cáncer en el cáncer de próstata. Además, los niveles de FGF-2 han mostrado una correlación directa con la progresión, la metástasis y el mal pronóstico de supervivencia en pacientes con cáncer colorrectal. En comparación con los controles libres de cáncer, los pacientes con carcinoma gástrico tienen niveles significativamente más altos de FGF-2 en su suero. Estos mensajeros inflamatorios han sido implicados en muchas enfermedades graves, ya sean de naturaleza inflamatoria o cancerosas. A diferencia de RANTES/CCL5 y FGF-2, se ha demostrado que IL1-ra actúa como un potente mediador antiinflamatorio, lo que contribuye a la falta de signos inflamatorios comunes en algunas lesiones de cavitación.
Los niveles excesivos de RANTES y FGF-2 en las lesiones de cavitación se han comparado y relacionado con los niveles observados en otras enfermedades sistémicas como la esclerosis lateral amiotrófica (ELA), la esclerosis múltiple (EM), la artritis reumatoide y el cáncer de mama. De hecho, los niveles de estos mensajeros detectados en las cavitaciones de la mandíbula son más altos que en el suero y el líquido cefalorraquídeo de pacientes con ELA y EM. La investigación actual realizada por Lechner y von Baehr ha demostrado un aumento de 26 veces en RANTES en las lesiones osteonecróticas de la mandíbula de pacientes con cáncer de mama. Lechner y sus colegas sugieren que RANTES derivado de la cavitación puede servir como acelerador del desarrollo y progresión del cáncer de mama.
Como se mencionó anteriormente, existen numerosos casos de cavitaciones mandibulares asintomáticas. En estos casos, las citocinas proinflamatorias agudas, como TNF-alfa e IL-6, NO se observan en mayor número en los hallazgos patohistológicos de las muestras de cavitación. En estos pacientes, la ausencia de estas citocinas proinflamatorias se asocia con niveles elevados de una citocina antiinflamatoria antagonista del receptor de interleucina 1 (Il-1ra). La conclusión razonable es que la inflamación aguda asociada con las cavitaciones de la mandíbula está bajo el control de niveles elevados de RANTES/FGF-2. Como resultado, para hacer un diagnóstico, Lechner y von Baehr sugieren restar importancia a la presencia de inflamación y considerar la vía de señalización, principalmente a través de la sobreexpresión de RANTES/FGF-2. Los altos niveles de RANTES/FGF-2 en pacientes con cavitación indican que estas lesiones podrían estar causando vías de señalización patógena similares y que se refuerzan mutuamente hacia otros órganos. El sistema inmunológico se activa en respuesta a señales de peligro, que evocan diversas vías moleculares innatas que culminan en la producción de citoquinas inflamatorias y la posible activación del sistema inmunológico adaptativo. Esto respalda la idea y la teoría de que las cavitaciones de los huesos de la mandíbula pueden servir como una causa fundamental de enfermedades inflamatorias crónicas a través de la producción de RANTES/FGF-2 y explica además por qué el paciente no siempre ve o siente los síntomas agudos de inflamación en las lesiones de la mandíbula. ellos mismos. Por tanto, las cavitaciones de la mandíbula y estos mensajeros implicados representan un aspecto integrativo de la enfermedad inflamatoria y sirven como una etiología potencial de la enfermedad. Eliminar las cavitaciones puede ser clave para revertir las enfermedades inflamatorias. Esto está respaldado por la observación de una reducción en los niveles séricos de RANTES después de la intervención quirúrgica en 5 pacientes con cáncer de mama (consulte la Tabla 5). Investigaciones y pruebas adicionales de los niveles de RANTES/CCL5 pueden proporcionar información sobre esta relación. Las observaciones alentadoras son las mejoras en la calidad de vida obtenidas por muchos pacientes con cavitación de la mandíbula, ya sea un alivio en el lugar de la operación o una disminución de la inflamación o enfermedad crónica en otros lugares.
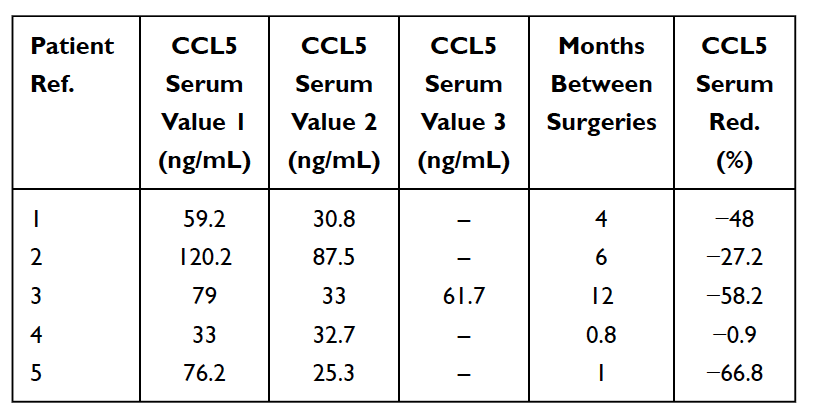
Tabla 5
Reducción (Red.) de RANTES/CCL5 en suero en 5 pacientes con cáncer de mama sometidas a cirugía por osteonecrosis grasa-degenerativa de la mandíbula (FDOJ). Tabla adaptada de
Lechner et al, 2021. Cavitación de la mandíbula expresada RANTES/CCL5: estudios de caso que vinculan la inflamación silenciosa en la mandíbula con la epistemología del cáncer de mama. Cáncer de mama: objetivos y terapia.
Debido a la escasez de literatura sobre el tratamiento de las lesiones cavitacionales, la IAOMT encuestó a sus miembros para recopilar información sobre qué tendencias y tratamientos se están desarrollando hacia un "estándar de atención". Los resultados de la encuesta se analizan brevemente en el Apéndice II.
Una vez que se determinan la ubicación y el tamaño de las lesiones, se necesitan modalidades de tratamiento. La IAOMT opina que, en general, es inaceptable dejar “hueso muerto” en el cuerpo humano. Esto se basa en datos que sugieren que las cavitaciones de la mandíbula pueden ser focos de citocinas y endotoxinas sistémicas para iniciar el proceso de degradación de la salud general del paciente.
En circunstancias ideales, se debe realizar una biopsia para confirmar el diagnóstico de cualquier patología de la mandíbula y descartar otras enfermedades. Entonces, es necesario un tratamiento para eliminar o eliminar la patología involucrada y estimular el nuevo crecimiento del hueso normal y vital. En este momento, en la literatura revisada por pares, la terapia quirúrgica que consiste en extirpar el hueso no vital afectado parece ser el tratamiento preferido para las cavitaciones de la mandíbula. El tratamiento implica el uso de anestésicos locales, lo que lleva a una consideración importante. Anteriormente se pensaba que los anestésicos que contienen epinefrina, que tienen propiedades vasoconstrictoras conocidas, deberían evitarse en pacientes que ya pueden tener un flujo sanguíneo comprometido asociado con su estado de enfermedad. Sin embargo, en una serie de estudios moleculares, la diferenciación osteoblástica aumentó con el uso de epinefrina. Por lo tanto, el médico debe determinar caso por caso si se debe usar epinefrina y, de ser así, la cantidad que se debe usar para obtener los mejores resultados.
Después de una decorticación quirúrgica y un curetaje minucioso de la lesión e irrigación con solución salina normal estéril, la curación se mejora mediante la colocación de injertos de fibrina rica en plaquetas (PRF) en el vacío óseo. El uso de concentrados de fibrina ricos en plaquetas en procedimientos quirúrgicos no sólo es beneficioso desde el punto de vista de la coagulación, sino también desde el punto de vista de la liberación de factores de crecimiento durante un período de hasta catorce días después de la cirugía. Antes del uso de injertos de PRF y otras terapias complementarias, la recaída de la lesión osteonecrótica de la mandíbula después de la cirugía ocurría hasta en el 40% de los casos.
Una lectura atenta de los factores de riesgo externos descritos en la Tabla 2 sugiere firmemente que se pueden evitar resultados desfavorables con una técnica quirúrgica adecuada y una interacción médico/paciente, especialmente en poblaciones susceptibles. Es aconsejable considerar la adopción de técnicas atraumáticas, minimizar o prevenir las enfermedades periodontales y otras enfermedades dentales, y elegir un armamento que permita obtener los mejores resultados de curación. Proporcionar instrucciones detalladas antes y después de la operación al paciente, incluidos los riesgos asociados con fumar cigarrillos, puede ayudar a minimizar los resultados negativos.
Teniendo en cuenta la amplia lista de posibles factores de riesgo enumerados en las Tablas 2 y 3, se recomienda consultar con el equipo de atención extendida del paciente para determinar adecuadamente cualquier posible factor de riesgo oculto que pueda contribuir al desarrollo de cavitaciones de la mandíbula. Por ejemplo, una consideración importante al tratar las cavitaciones de la mandíbula es si el individuo está tomando antidepresivos, específicamente inhibidores selectivos de la recaptación de serotonina (ISRS). Los ISRS se han asociado con una reducción de la densidad de masa ósea y un aumento de las tasas de fracturas. El ISRS Fluoxetina (Prozac) inhibe directamente la diferenciación y mineralización de los osteoblastos. Al menos dos estudios independientes que examinaron a los usuarios de ISRS en comparación con los controles han demostrado que el uso de ISRS se asocia con peores índices morfométricos panorámicos.
El acondicionamiento previo también puede contribuir a resultados exitosos del tratamiento. Esto implica crear un entorno tisular propicio para la curación suministrando al cuerpo niveles adecuados de nutrientes apropiados que mejoren el terreno biológico optimizando la homeostasis en el cuerpo. Las tácticas de precondicionamiento no siempre son posibles o aceptables para el paciente, pero son más importantes para aquellos pacientes que tienen susceptibilidades conocidas, como aquellos con predisposición genética, trastornos de curación o salud comprometida. En tales casos, es fundamental que esta optimización se produzca para minimizar los niveles de estrés oxidativo, que no sólo puede estimular el proceso de la enfermedad sino que también puede interferir con la curación deseada.
Idealmente, la reducción de cualquier carga tóxica en el cuerpo, como el fluoruro y/o el mercurio procedente de los empastes de amalgama dental, debería completarse antes del tratamiento de las cavitaciones de la mandíbula. El mercurio puede desplazar al hierro en la cadena de transporte de electrones de las mitocondrias. Esto da como resultado un exceso de hierro libre (hierro ferroso o Fe++), lo que produce especies reactivas de oxígeno (ROS) dañinas, también conocidas como radicales libres, que causan estrés oxidativo. El exceso de hierro en el tejido óseo también inhibe el correcto funcionamiento de los osteoblastos, lo que obviamente tendrá un efecto negativo a la hora de intentar curar un trastorno óseo.
Otras deficiencias también deben abordarse antes del tratamiento. Cuando hay una deficiencia de cobre, magnesio y retinol biodisponibles, el metabolismo y el reciclaje del hierro se desregulan en el cuerpo, lo que contribuye al exceso de hierro libre en los lugares equivocados, lo que conduce a un estrés oxidativo aún mayor y al riesgo de enfermedades. Más específicamente, muchas enzimas del cuerpo (como la ceruloplasmina) se vuelven inactivas cuando hay niveles insuficientes de cobre, magnesio y retinol biodisponibles, lo que perpetúa la desregulación sistémica del hierro y el consiguiente aumento del estrés oxidativo y el riesgo de enfermedad.
Estrategias de tratamiento alternativas
También se deben evaluar técnicas alternativas que se utilizan como terapias primarias o de apoyo. Estos incluyen homeopatía, estimulación eléctrica, fototerapia como fotobiomodulación y láser, oxígeno/ozono de grado médico, oxígeno hiperbárico, modalidades de anticoagulación, remedios Sanum, nutrición y nutracéuticos, sauna de infrarrojos, ozonoterapia intravenosa, tratamientos energéticos y otros. En este momento, no se han realizado estudios científicos que confirmen que estas formas alternativas de tratamiento sean viables o ineficaces. Se deben establecer estándares de atención para garantizar una curación y desintoxicación adecuadas. Las técnicas para evaluar el éxito deben probarse y estandarizarse. Se deben presentar para evaluación protocolos o procedimientos que ayuden a determinar cuándo el tratamiento es apropiado y cuándo no.
Las investigaciones han demostrado que la presencia de cavitaciones en la mandíbula es un proceso patológico insidioso asociado con un flujo sanguíneo reducido. El flujo sanguíneo medular comprometido conduce a una vascularización deficiente y mineralizada en áreas de la mandíbula que pueden infectarse con patógenos, lo que aumenta la muerte celular. El flujo sanguíneo lento dentro de las lesiones cavitacionales dificulta la entrega de antibióticos, nutrientes y mensajeros inmunológicos. El entorno isquémico también puede albergar y promover mediadores inflamatorios crónicos que pueden tener efectos aún más nocivos sobre la salud sistémica. La predisposición genética, la función inmune reducida, los efectos de ciertos medicamentos, los traumatismos y las infecciones, y otros factores como fumar pueden instigar o acelerar el desarrollo de cavitaciones en la mandíbula.
Junto con el eminente patólogo de la mandíbula, el Dr. Jerry Bouquot, la IAOMT está presentando y promoviendo una identificación histológica y patológicamente correcta de las lesiones cavitacionales de la mandíbula como enfermedad medular isquémica crónica de la mandíbula, CIMDJ. Aunque históricamente y se utilizan muchos nombres, acrónimos y términos para designar esta enfermedad, la IAOMT está convencida de que este es el término más apropiado para describir la condición patológica y microhistológica que se encuentra comúnmente en las cavitaciones de la mandíbula.
Aunque la mayoría de las lesiones cavitacionales de la mandíbula son difíciles de diagnosticar con radiografías de rutina y la mayoría no son dolorosas, nunca se debe asumir que el proceso de la enfermedad no existe. Hay muchas enfermedades que son difíciles de diagnosticar y muchas que no son dolorosas. Si utilizáramos el dolor como indicador del tratamiento, la enfermedad periodontal, la diabetes y la mayoría de los cánceres no serían tratados. El odontólogo actual tiene un amplio espectro de modalidades para tratar con éxito las cavitaciones de la mandíbula y no reconocer la enfermedad y recomendar un tratamiento no es menos grave que no diagnosticar y tratar la enfermedad periodontal. Para la salud y el bienestar de nuestros pacientes, un cambio de paradigma es crucial para que todos los profesionales de la salud, incluidos los odontólogos y los médicos, 1) reconozcan la prevalencia de las cavitaciones de la mandíbula y 2) reconozcan el vínculo entre las cavitaciones de la mandíbula y las enfermedades sistémicas.
RESULTADOS DE LA ENCUESTA IAOMT 2 (2023)
Como se analiza brevemente en el artículo, las afecciones no relacionadas a menudo remiten después de la cirugía de cavitación. Para obtener más información sobre qué tipos de afecciones se resuelven y cómo se produce la remisión proximal en relación con la cirugía, se envió una segunda encuesta a los miembros de la IAOMT. Para la encuesta se compiló una lista de síntomas y condiciones que los miembros de este comité han observado que mejoran después de la cirugía. Se preguntó a los encuestados si habían observado que alguna de estas condiciones remitía después de la cirugía y, de ser así, en qué grado. También se les preguntó si los síntomas remitieron rápidamente o si las mejoras tardaron más de dos meses. Además, se preguntó a los encuestados si normalmente realizaban cirugía en sitios individuales, en múltiples sitios unilaterales o en todos los sitios en una sola cirugía. Los resultados de la encuesta se presentan en las figuras siguientes. Los datos son preliminares, dado que el número de encuestados fue pequeño (33) y que faltan algunos datos.
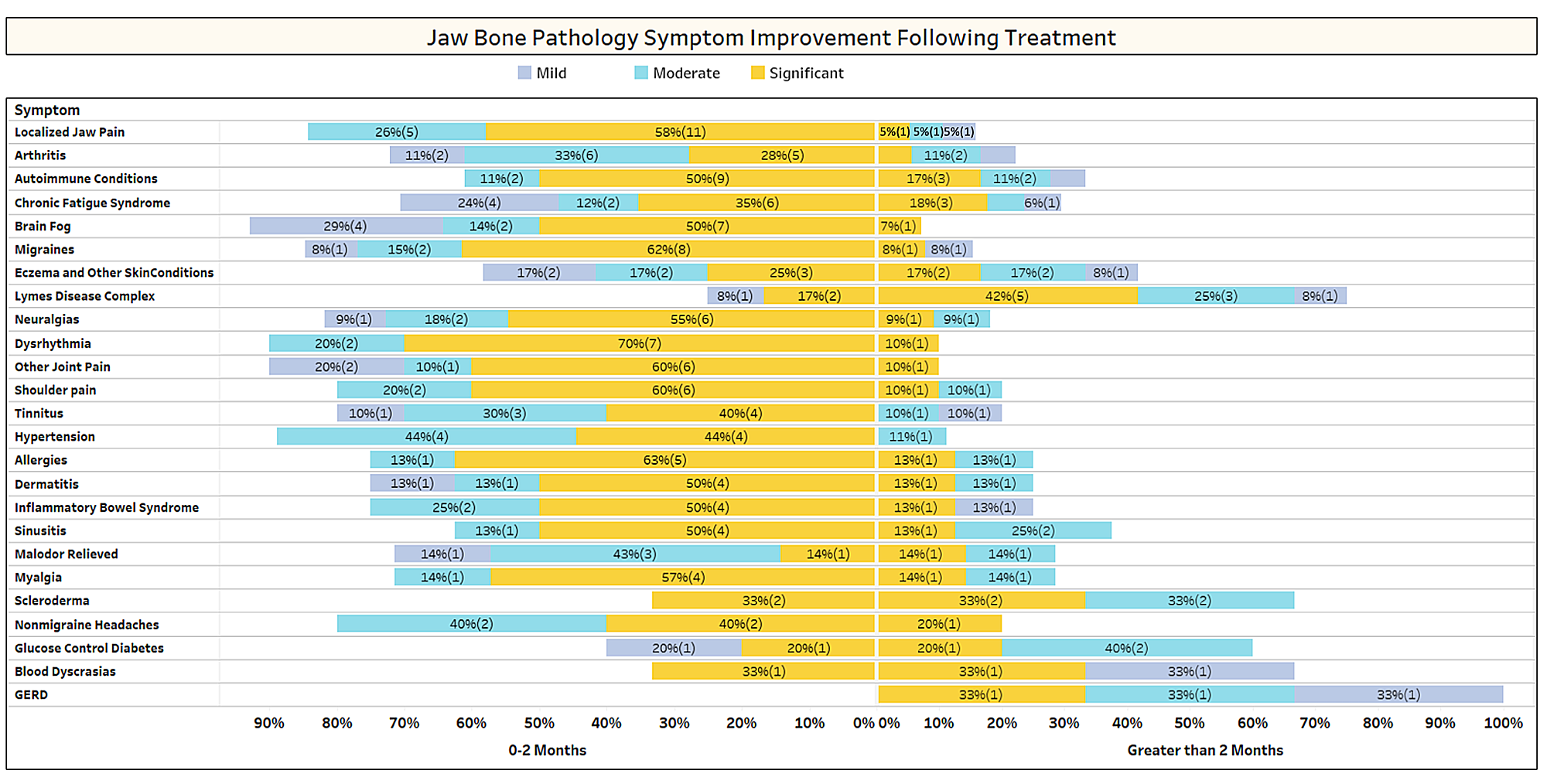
Apéndice I Fig. 1 Los encuestados calificaron el nivel de mejora (leve, moderada o significativa) y anotaron si la mejora se produjo rápidamente (0-2 meses) o tomó más tiempo (> 2 meses). Las condiciones/síntomas se enumeran en el orden en que más se informan. Tenga en cuenta que la mayoría de las afecciones/síntomas remitieron en menos de dos meses (lado izquierdo de la línea media).
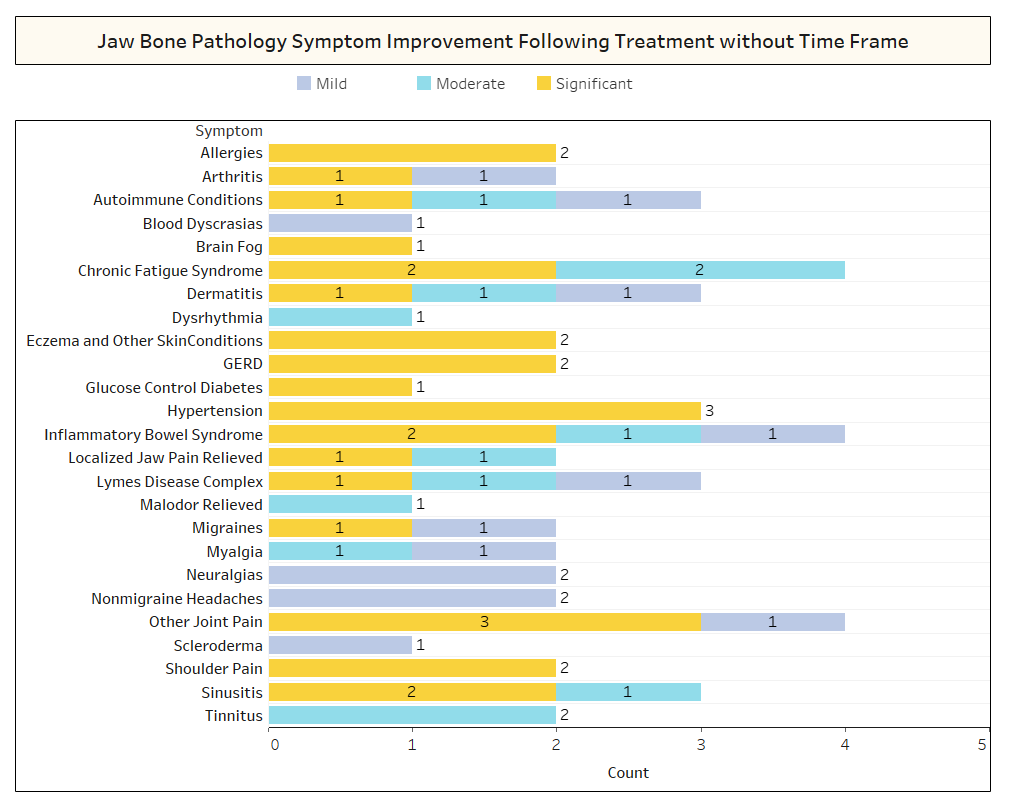
Apéndice I Fig. 2 Como se muestra arriba, en varios casos, los encuestados no señalaron el plazo de recuperación de las mejoras que se observaron.
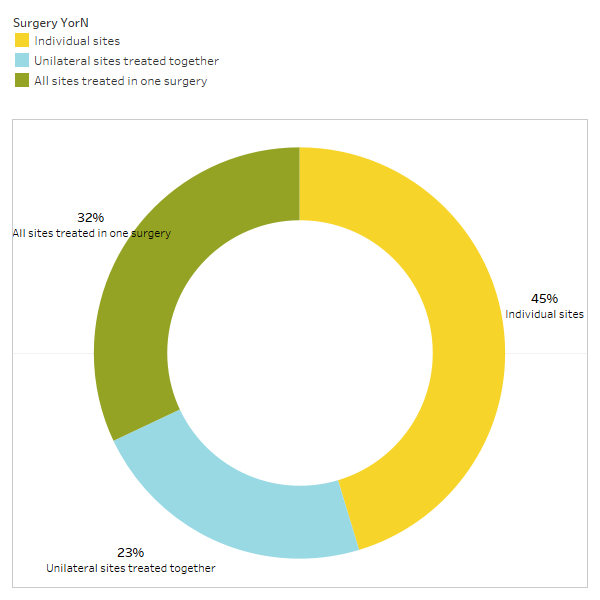
Apéndice I Fig. 3 Los encuestados respondieron a la pregunta: "¿Normalmente recomiendas/realizas
¿Una cirugía para sitios individuales, sitios unilaterales tratados juntos o todos los sitios tratados en una sola cirugía?
RESULTADOS DE LA ENCUESTA IAOMT 1 (2021)
Debido a la escasez de literatura y revisiones de casos clínicos relacionados con el tratamiento de lesiones cavitacionales, la IAOMT encuestó a sus miembros para recopilar información sobre las tendencias y tratamientos que se están desarrollando hacia un "estándar de atención". La encuesta completa está disponible en el sitio web de la IAOMT (tenga en cuenta que no todos los profesionales respondieron a todas las consultas de la encuesta).
Para resumir brevemente, la mayoría de los 79 encuestados ofrecen tratamiento quirúrgico, que implica reflexión de los tejidos blandos, acceso quirúrgico al sitio de cavitación y varios métodos de "limpieza" y desinfección física del sitio afectado. Se utiliza una amplia gama de medicamentos, nutracéuticos y/o productos sanguíneos para promover la curación de la lesión antes de cerrar la incisión del tejido blando.
Las fresas rotatorias se utilizan a menudo para abrir o acceder a la lesión ósea. La mayoría de los médicos utilizan un instrumento manual para raspar o raspar el hueso enfermo (68%), pero también se utilizan otras técnicas y herramientas, como una fresa rotatoria (40%), un instrumento piezoeléctrico (ultrasónico) (35%) o un Láser ER:YAG (36%), que es una frecuencia láser utilizada para transmisión fotoacústica.
Una vez que el sitio se limpia, se desbrida y/o se curetea, la mayoría de los encuestados usan agua/gas con ozono para desinfectar y promover la curación. El 86% de los encuestados utiliza PRF (fibrina rica en plaquetas), PRP (plasma rico en plaquetas) o PRF o PRP ozonizado. Una técnica de desinfección prometedora reportada en la literatura y dentro de esta encuesta (42%) es el uso intraoperatorio de Er:YAG. El 32% de los encuestados no utiliza ningún tipo de injerto óseo para rellenar el sitio de cavitación.
La mayoría de los encuestados (59%) generalmente no realizan biopsias de las lesiones, indicando una variedad de razones, desde el costo, la incapacidad de obtener muestras de tejido viables, la dificultad para encontrar un laboratorio de patología o la certeza del estado de la enfermedad.
La mayoría de los encuestados no usan antibióticos antes de la operación (79%), durante la cirugía (95%) o después de la operación (69%). Otro soporte intravenoso que se utiliza incluye esteroides dexametasona (8%) y vitamina C (48%). Muchos encuestados (52%) utilizan la terapia con láser de baja intensidad (LLLT) después de la operación con fines curativos. Muchos encuestados recomiendan un apoyo nutricional que incluya vitaminas, minerales y diversos homeopáticos antes (81%) y durante (93%) del período de curación.
 Imágenes
Imágenes
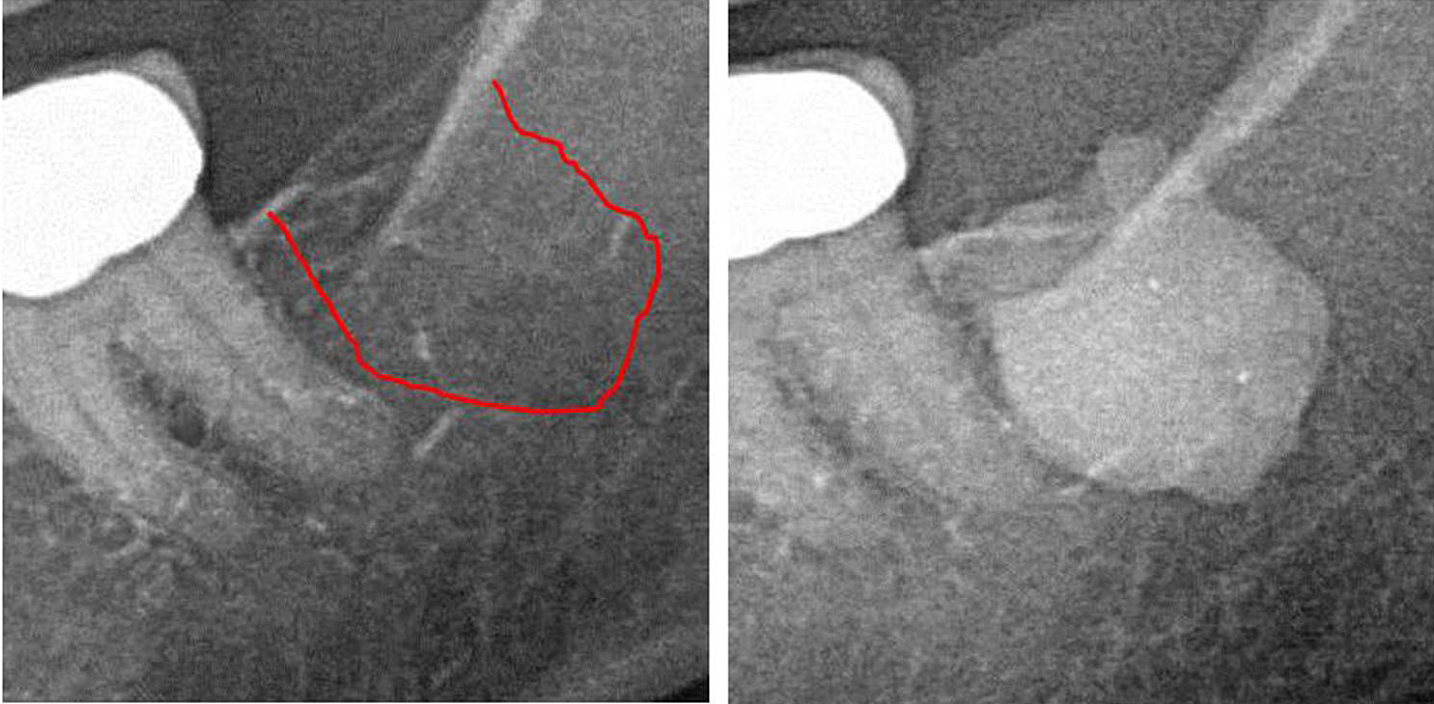
Apéndice III Fig. 1 Panel izquierdo: Diagnóstico por rayos X 2D del área #38. Panel derecho: documentación de la extensión de FDO) en el área retromolar 38/39 usando un agente de contraste después de la cirugía FDOJ.
abreviaturas: FDOJ, osteonecrosis grasa degenerativa de la mandíbula.
Adaptado de Lechner, et al, 2021. “Cavitación de la mandíbula expresada en RANTES/CCL5: estudios de caso que vinculan la inflamación silenciosa en la mandíbula con la epistemología del cáncer de mama”. Cáncer de mama: objetivos y terapia
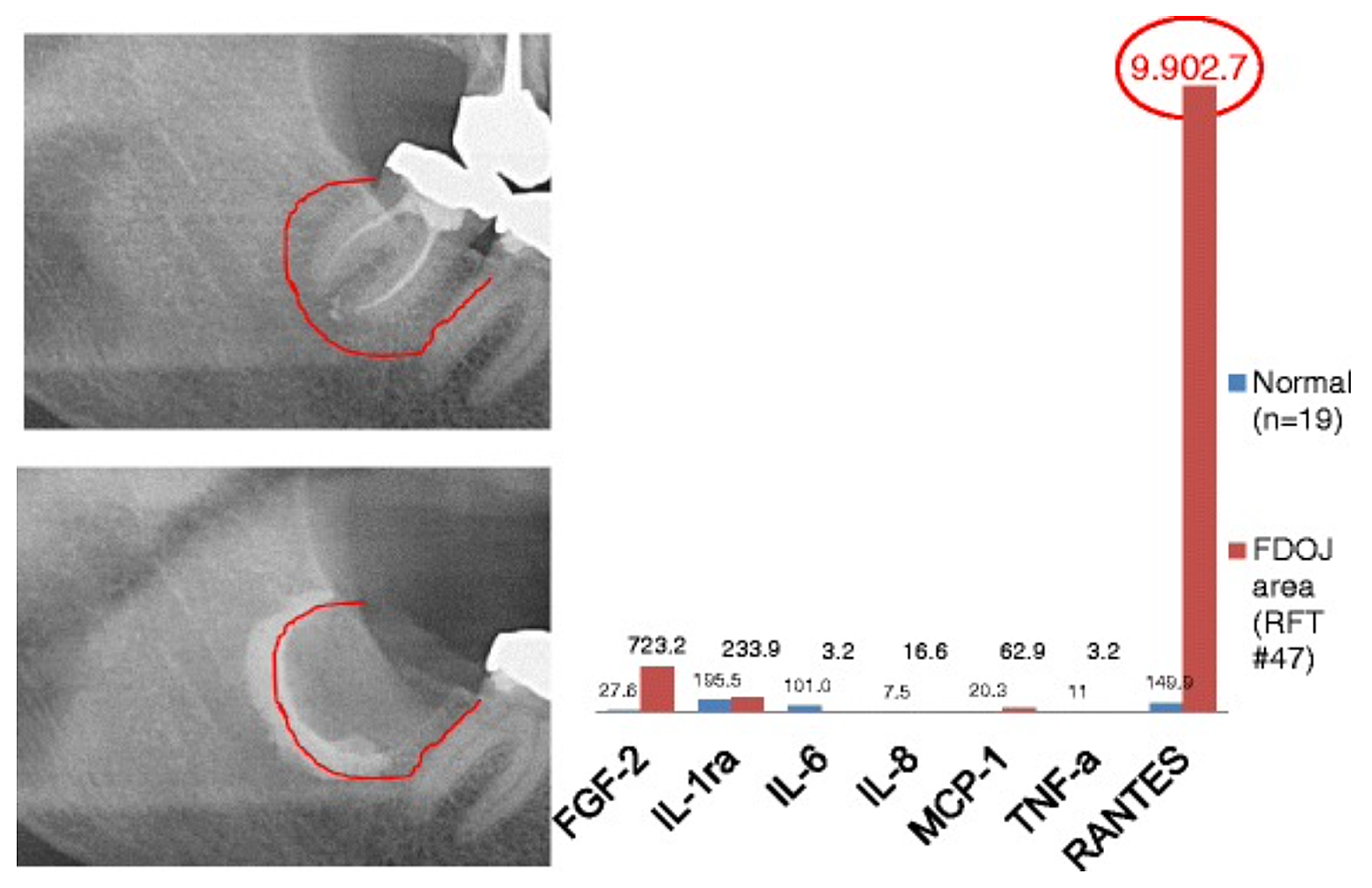
Apx 3 Fig. 2 Comparación de siete citocinas (FGF-2, IL-1ra, IL-6, IL-8, MCP-1, TNF-a y RANTES) en FDOJ debajo de RFT #47 con las citocinas en la mandíbula sana (n = 19). Documentación intraoperatoria de la extensión de FDOJ en el maxilar inferior derecho, área #47 apicalmente del RFT #47, mediante agente de contraste después de la extirpación quirúrgica del RFT #47.
abreviaturas: FDOJ, osteonecrosis grasa degenerativa de la mandíbula.
Adaptado de Lechner y von Baehr, 2015. “La quimiocina RANTES/CCL5 como vínculo desconocido entre la cicatrización de heridas en la mandíbula y la enfermedad sistémica: ¿Están en el horizonte la predicción y los tratamientos personalizados?” La revista EPMA
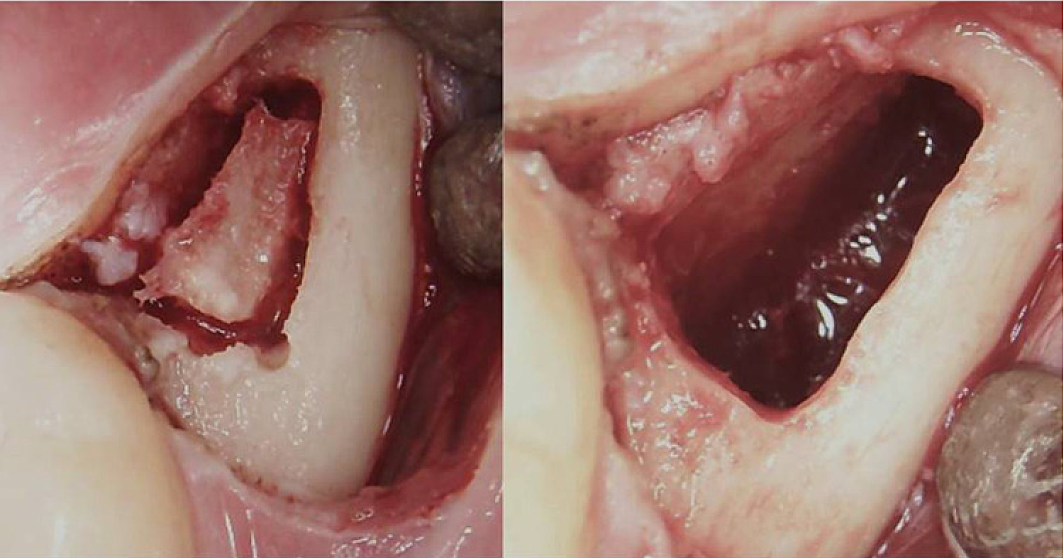
Apéndice III Fig. 3 Procedimiento quirúrgico para un BMDJ/FDOJ retromolar. Panel izquierdo: después de plegar el colgajo mucoperióstico, se formó una ventana ósea en la corteza. Panel derecho: cavidad medular curetada.
Abreviaturas: BMDJ, defecto de la médula ósea en la mandíbula; FDOJ, osteonecrosis grasa degenerativa de la mandíbula.
Adaptado de Lechner, et al, 2021. “Síndrome de fatiga crónica y defectos de la médula ósea de la mandíbula: informe de un caso sobre diagnósticos dentales adicionales por rayos X con ultrasonido”. Revista internacional de informes de casos médicos
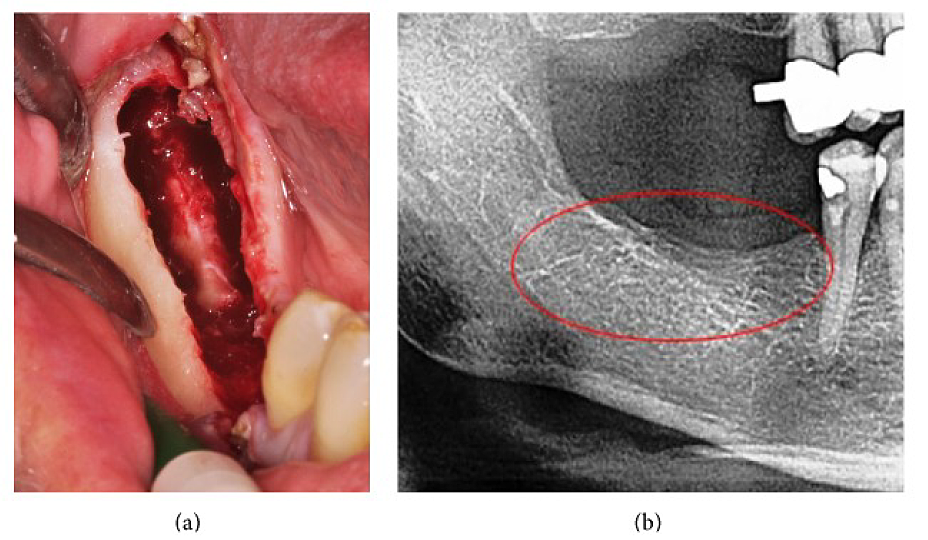
Apéndice III Fig. 4 (a) Legrado de FDOJ en la mandíbula inferior con nervio infraalveolar desnudo. (b) Radiografía correspondiente sin signos de proceso patológico en mandíbula.
Abreviaturas: FDOJ, osteonecrosis grasa degenerativa de la mandíbula
Adaptado de Lechner, et al, 2015. “Dolor facial/trigémino neuropático periférico y RANTES/CCL5 en la cavitación de la mandíbula”. Basada en la Evidencia Medicina complementaria y alternativa
Apéndice III Película 1
Videoclip (haga doble clic en la imagen para ver el clip) de una cirugía de mandíbula que muestra glóbulos de grasa y secreción purulenta de la mandíbula de un paciente que se sospechaba que tenía necrosis de la mandíbula. Cortesía del Dr. Miguel Stanley, DDS
Apéndice III Película 2
Videoclip (haga doble clic en la imagen para ver el clip) de una cirugía de mandíbula que muestra glóbulos de grasa y secreción purulenta de la mandíbula de un paciente que se sospechaba que tenía necrosis de la mandíbula. Cortesía del Dr. Miguel Stanley, DDS
Para descargar o imprimir esta página en un idioma diferente, primero elija su idioma en el menú desplegable en la parte superior izquierda.
Autores del documento de posición de la IAOMT sobre las cavitaciones de la mandíbula humana













